
電話:
021-67610176傳真:
前言
癌癥疫苗是近年來興起的一種全新的免疫療法。癌癥疫苗,是通過利用腫瘤細胞相關抗原,來喚醒人體針對癌癥的免疫系統。美國食品及藥品管理局(FDA)一個顧問委員會全票通過了允許默沙東公司(Merck)宮頸癌疫苗上市的建議,這意味著人類抗癌戰爭即將進入一個劃時代的新階段。
那么宮頸癌疫苗到底是不是癌癥疫苗呢?宮頸癌疫苗,又稱為HPV疫苗,是一種預防宮頸癌發病的疫苗。宮頸癌主要由感染人乳頭瘤病毒(HPV)引起,該疫苗通過預防HPV病毒感染,進而有效預防了宮頸癌的發病,可防止人體感染疫苗所涵蓋的人乳頭狀瘤病毒亞型變異。研究發現99.7%的宮頸癌都是因感染HPV造成的,HPV也可以引發其他相對少見的癌癥,如喉癌、肺癌和肛門癌等。HPV的主要途徑是性或皮膚與皮膚接觸傳播。
現有宮頸癌疫苗種類:
HPV 2價疫苗
2016年07月12日,國家食品藥品監督管理總局批準葛蘭素史克(GSK)公司的預防用生物制品 — 人乳頭瘤病毒吸附疫苗的進口注冊申請。該產品系采用桿狀病毒表達系統分別表達重組HPV16和18型的L1病毒樣顆粒,經純化,添加MPL和氫氧化鋁佐劑等制備的雙價疫苗。該疫苗是申請在我國上市的新疫苗,研究數據表明在國內目標人群中應用的安全性和有效性與國外具有一致性。 [2]
已有資料顯示,HPV16和18型感染率zui高,導致了70%的宮頸癌、80%的肛門癌、60%的yin道腫瘤和40%的外陰癌。 [1]
HPV 4價疫苗
默沙東公司研發出*個HPV4價疫苗“佳達修®”(Gardasil®),并通過優先審批在美國上市。這款四價疫苗防治HPV16、18、6、11型病毒,可預防四種人乳頭瘤病毒(HPV 6, 11, 16, 18)所導致的疾病。 [3]
HPV 9價疫苗
美國食品藥品監督管理局(FDA)2014年12月10日在其宣布:默沙東(在美國和加拿大稱為默克)研發的GARDASIL 9(佳達修,九價重組人乳頭狀瘤病毒疫苗)獲批。這款9價疫苗可以防治6、11、16、18、31、33、45、52和58型病毒。
由以上信息可知:宮頸癌疫苗只是針對HPV病毒的傳播的一種抵抗病毒疫苗。而并不是針對癌細胞的疫苗,頂多只能稱得上是癌癥相關疫苗。
有些癌癥疫苗沒有獲得類似FDA的批準,但依靠患者的口碑相傳已經存在市場上長達數年,例如日本的蓮見疫苗(Hasumi Vaccine)。那么蓮見疫苗是不是癌癥疫苗呢?
蓮見疫苗(Hasumi Vaccine),根據抗原來源分為普通疫苗和自家疫苗。根據作用可分為癌癥預防型和癌癥治療型。由日本蓮見喜一郎醫師于1948年研發而成,并歷經數十年發展。期間,喜一郎醫師的兒子蓮見賢一郎多次研發升級,目前應用的HITV疫苗是2005年通過臨床正式投入市場。在日本,每年約有15,000名癌癥病人接受此項治療。
蓮見疫苗包含一份抗原及一份免疫促進劑,抗原是由各種不同的腫瘤中萃取,再分離成多糖體及糖蛋白體;而免疫促進劑則是由小牛脾臟萃取,含有不飽和脂肪酸及其他物質。蓮見賢一郎表示,該疫苗并非直接殺死癌細胞,而是極大的提高了人體免疫活性即提高樹狀細胞等處理抗原的能力,進而誘導出對應的淋巴球細胞消滅攻擊癌細胞,達到防范癌癥復發及轉移的作用。

*,癌癥的一大特點,便是遺傳變異的大量積累。隨著突變一個接一個的出現,人體內會出現癌癥特異性的新抗原表位,它們也是癌癥疫苗的理想靶點。隨著基因組學、數據科學、以及癌癥免疫療法的進步,現在我們已經能快速地在基因組里尋找到突變,并合理地選擇出適用于疫苗開發的靶點,按需生產出針對特定患者的個體化疫苗。在人體中的臨床試驗也表明,此類癌癥疫苗安全有效,能針對個體腫瘤突變產生免疫應答。
由此可見蓮見疫苗是典型的癌癥疫苗。

日前發表在《Science Translational Medicine》上的一項研究表明,個體化疫苗已讓一名晚期卵巢癌5年無癌,也讓我們看到了這類全新療法的無限潛力。zui近適逢《科學》雜志推出癌癥免疫療法特刊,以回顧不同領域所取得的成就。本文對癌癥疫苗近幾年的發展進行了梳理。


癌癥疫苗的研發簡史

早在100多年前,人們就意識到體細胞的突變可以帶來新的免疫原性——基因突變會影響蛋白序列,蛋白序列的改變則會帶來新的抗原表位。盡管出現在人體內部,免疫系統依舊會把這些新表位視為“異鄉人”,對其發動攻擊。這一理念簡單易懂,但癌癥疫苗一直沒有得到有效的開發。背后的原因,則是因為我們不知道如何去靶向特定的癌癥及其抗原。

半個多世紀后,通過大量實驗,我們從機理上對癌癥疫苗的理解又有了加深。1950年代,人們發現小鼠對同一類型的癌癥細胞會產生免疫力,適應性腫瘤免疫力的概念也隨之提出;1970年代,人們發現腫瘤里獲取的T細胞能有效地識別腫瘤細胞系;1980年代,分子克隆技術的引入讓我們對腫瘤抗原的了解獲得了進一步的提高。
雖然在過去的幾十年里,關于癌癥疫苗的科學有著飛速發展,但科研人員們卻面臨著一大瓶頸——許多突變往往具有“患者特異性”。也就是說,在一名患者身上出現的大量突變,可能壓根不在另一名患者身上重現。為此,過去的癌癥疫苗往往針對“共通”的突變進行研發,但效果不如人意。

臨床前研究與臨床轉化

隨著新一代測序(NGS)等技術的普及,了解患者的特異性突變已經不再是個難題。然而初步研究卻發現,大約只有1%左右的突變會帶來自發的免疫反應。如果這一比例具有代表性,那對于癌癥疫苗的開發而言并不算什么好消息。
幸運的是,進一步的研究表明,實際上能引起免疫應答的突變比例要高得多,大部分新表位都能被CD4+ 輔助性T細胞所識別。在小鼠模型中,針對這些新表位開發出的疫苗能有效控制小鼠的晚期腫瘤。
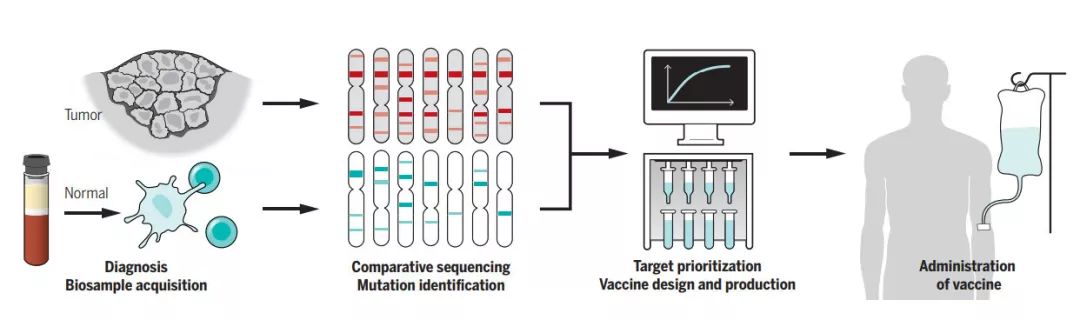
▲個體化癌癥疫苗的開發(圖片來源:K. SUTLIFF/SCIENCE)
但從小鼠到人類的轉化并不是一項簡單的工作。為了在人體內復制成功,我們需要經歷鑒別突變、預測表位、設計疫苗、并生產疫苗這一系列復雜的工作。在3項治療惡性黑色素瘤的早期臨床試驗中,癌癥疫苗在人體內的可行性得到了驗證。無論是使用代表腫瘤突變的多肽,還是編碼腫瘤突變的RNA,這些疫苗均取得了可喜的進展,總體免疫原性率達60%。而接受疫苗的每名患者,也都對其腫瘤突變產生了強有力的T細胞反應。
總體來看,這些小型的早期臨床試驗證明了癌癥疫苗的潛力,也為進一步的研發指明了方向。

新抗原表位的預測與選擇

個體化癌癥疫苗的關鍵之一,在于地找到腫瘤的“突變組”(mutanome),并由此選擇能帶來*免疫反應的那些突變。要做到這一點,首先我們需要發現腫瘤患者中的突變。目前,我們常用的手段是利用NGS技術,比較腫瘤樣本與健康組織外顯子組中的異同。但這樣的做法可能有幾個局限,其一是這些腫瘤樣本往往來自患者的活檢,而活檢獲得的小塊腫瘤可能不具有代表性;其二是目前的分析算法僅能確保單核苷酸變異(SNV)和插入/刪除突變(indels)的準確性,但還無法準確體現出表觀遺傳學、轉錄、翻譯、翻譯后修飾等環節為癌癥新表位帶來的影響。
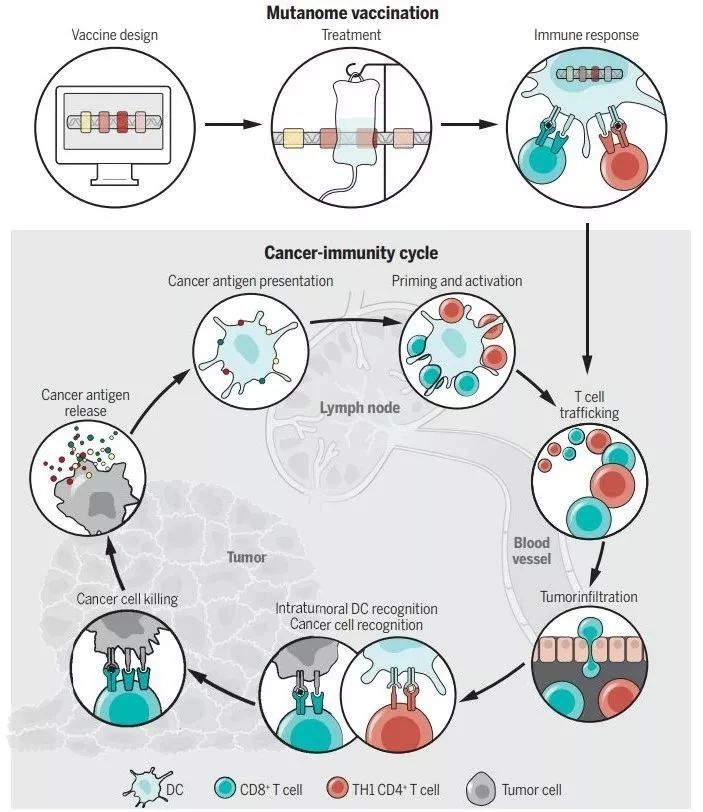
▲新抗原在癌癥免疫中的作用(圖片來源:K. SUTLIFF/SCIENCE)
找到腫瘤突變后,我們還需要從中做出選擇,挑選出開發成疫苗的突變類型。限于成本與技術,我們無法將所有的突變都置入產品之中,而我們也知道,只有部分突變序列足以讓效應T細胞做出回應。因此,如何在這些限制之下,挑選出有免疫原性的突變,就成了癌癥疫苗開發的一大關鍵。
目前,我們對于如何挑選這些突變用于后續開發,還沒有一個放之四海皆準的共識。但研究人員們已經總結出來了幾個行之有效的原則,譬如突變基因在腫瘤里的表達量,抑或是突變產生“可呈遞”表位的能力。此外,經驗還告訴我們,如果特定的突變在異質性腫瘤的多個克隆里都普遍具有表達,那么該突變“成疫苗”的潛力可能也更高。

個體化疫苗的制造與臨床應用

在臨床應用上,個體化疫苗所遇到zui大的挑戰之一,便是如何快速地制造這些疫苗,并及時地送到每一名患者身邊。目前來看,個體化癌癥疫苗的種類繁多,類型包括長多肽、RNA、DNA質粒、病毒載體、改造細菌、以及載有抗原的樹突狀細胞。根據類型不同,癌癥疫苗的制造周期也有所區別。從臨床試驗中獲得的數據看,無論是采取多肽還是RNA類型,從發現突變到疫苗開發,再到疫苗施用,這一過程需要3-4個月的時間。因此患者在等待時,不得不先接受其他療法的治療。將來,研究人員期望將這一時間縮短到一個月。
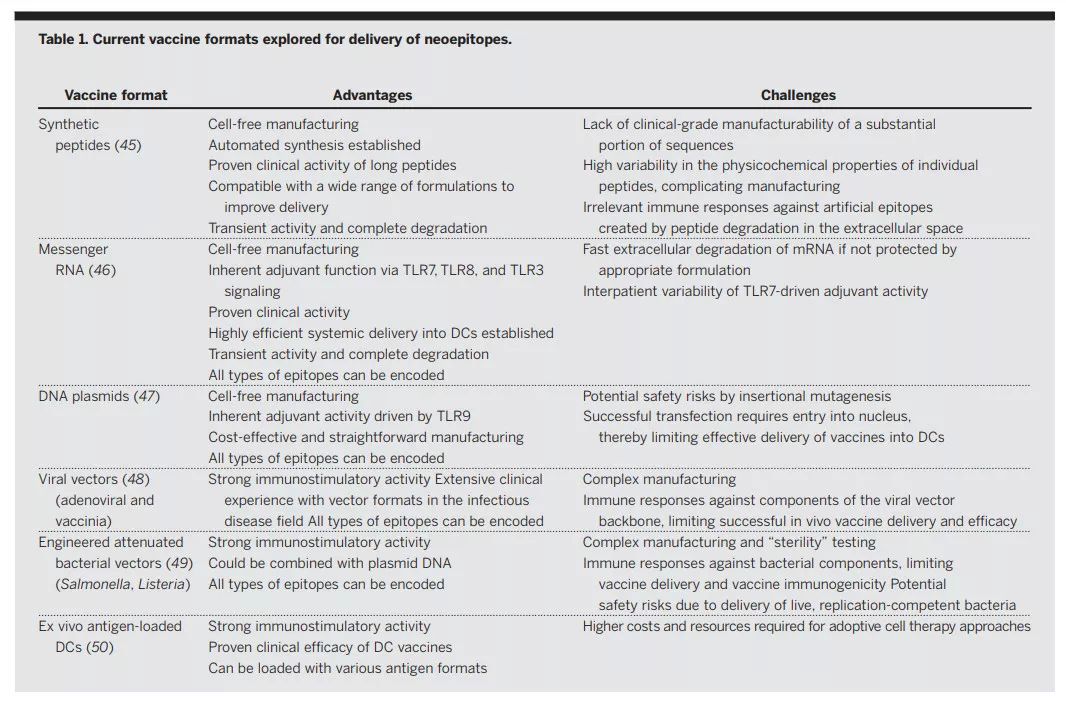
▲不同類型的癌癥疫苗(圖片來源:《科學》)
個體化疫苗在臨床應用上的另一個挑戰是確定*的治療策略。對于那些免疫系統尚未得到抑制的患者,癌癥疫苗有望發揮奇效。而對于腫瘤具有大量突變的患者,我們或許就應考慮癌癥疫苗+免疫檢查點抑制劑的組合。這是因為癌癥疫苗可以將“冷腫瘤”變成“熱腫瘤”,上調PD-L1在腫瘤微環境里的水平,抗PD-1/PD-L1的免疫檢查點抑制劑也因此有了用武之地。目前,新抗原表位疫苗與PD-1/PD-L1、CTLA4、LAG-3、TIM-3、以及TGF- β的組合也正在多項臨床試驗中進行評估。

個體化免疫療法的未來

在《科學》雜志的這篇綜述中,作者Ugur Sahin博士與Özlem Türeci博士指出在目前的語境下,“個體化治療”往往是“患者分層”的同義詞。根據患者的生物標志物進行分組并展開特定的治療固然是一大進步,也取得了良好的效果,但從狹義上看,這種治療理念還沒有做到真正的“個體化”。而且我們也不能忘記,許多癌癥患者并沒有可用來分組的生物標志物,他們同樣需要行之有效的療法。在這一點上,癌癥疫苗可能帶來突破。
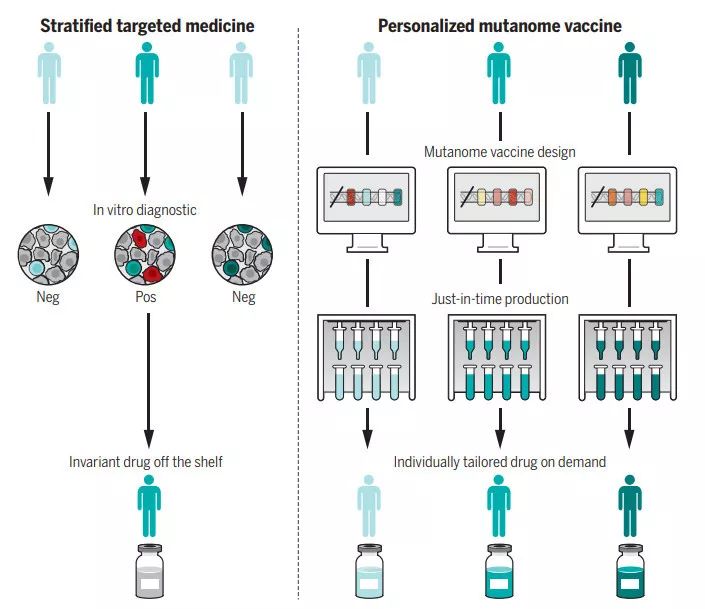
▲癌癥疫苗代表了一類潛力的個體化療法(圖片來源:K. SUTLIFF/SCIENCE)