
電話:
021-67610176傳真:
5月份Science期刊又有哪些亮點研究值得學習呢?小編對此進行了整理,與各位分享。
1.Science:腸道微生物組竟能控制肝臟中的抗腫瘤免疫反應
doi:10.1126/science.aan5931; doi:10.1126/science.aat8289
在一項新的研究中,來自美國、德國和泰國的研究人員發現腸道細菌與肝臟中的抗腫瘤免疫反應之間存在關聯。他們證實在小鼠腸道中發現的細菌會影響肝臟的抗腫瘤免疫功能。這些發現對理解導致肝癌的機制和開發治療肝癌的方法產生影響。相關研究結果發表在2018 年5月25日的Science期刊上,論文標題為“Gut microbiome–mediated bile acid metabolism regulates liver cancer via NKT cells”。
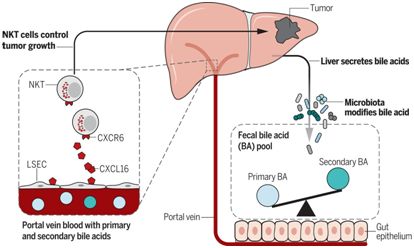
圖片來自Science,doi:10.1126/science.aan5931。
為了研究腸道細菌是否會影響肝臟中的腫瘤產生,Greten博士和他的團隊對小鼠進行了一系列實驗。他們使用了三種小鼠肝癌模型,并發現當他們利用抗生素混合物消滅腸道細菌時,接受抗生素治療的小鼠形成更少更小的肝臟腫瘤并且降低腫瘤轉移到肝臟中。
這些研究人員接下來研究了肝臟中的免疫細胞以便理解消滅腸道細菌如何抑制接受抗生素治療的小鼠肝臟中的腫瘤生長。抗生素治療增加了這些小鼠肝臟中的一類被稱作稱為自然殺傷T細胞(NKT細胞)的免疫細胞的數量。進一步的實驗表明在所有的三種小鼠模型中,因 抗生素治療導致的肝臟腫瘤生長下降依賴于這些NKT細胞。接下來,他們發現這些NKT細胞在肝臟中的積累是由于位于肝臟毛細血管內部的肝竇內皮細胞表面上的CXCL16蛋白表達增加所導致的。
Greten 博士說,“我們問自己,為什么用抗生素治療的小鼠在它們的這些內皮細胞中產生更多的CXCL16?當時我們發現膽酸(bile acid, 也譯作膽汁酸)能夠控制CXCL16表達時,這是非常關鍵的。我們隨后開展進一步的研究,發現如果我們用膽酸治療小鼠,那么我們 實際上能夠改變肝臟中的NKT細胞數量,因而改變肝臟中的腫瘤數量。”
zui后,這些研究人員發現,一種被稱作Clostridium scindens的梭菌物種控制小鼠腸道中的膽酸代謝,并zui終控制肝臟中的CXCL16表達、NKT細胞積累和腫瘤生長。
2.Science:揭示有益細菌利用免疫反應在腸道中安營扎寨
doi:10.1126/science.aaq0926
在一項新的研究中,來自美國加州理工學院的Sarkis Mazmanian教授及其團隊證實一種特定類型的有益細菌實際上利用身體的免疫反應使得它能夠舒適地在腸道中安營扎寨。相關研究結果于2018年5月3日在線發表在Science期刊上,論文標題為“Gut microbiota utilize immunoglobulin A for mucosal colonization”。
Mazmanian團隊選擇研究一種被稱作脆弱擬桿菌(Bacterioides fragilis)的細菌。這種特定的細菌種類在包括人類在內的許多哺乳動物的大腸中大量存在,而且Mazmanian團隊之前已證實它保護小鼠免受某些炎性疾病和神經疾病(比如炎癥性腸病和多發性硬化癥)的影響。令人關注的是,盡管存在多種脆弱擬桿菌菌株,但是健康人僅與一種脆弱擬桿菌菌株形成長期的一對一關系。
首先,這些研究人員旨在通過物理觀察脆弱擬桿菌所在的位置來研究這種細菌與腸道的共生關系。通過對小鼠腸道樣品進行電鏡成像,他們能夠觀察到脆弱擬桿菌聚集在較厚的腸道粘液層(即粘膜層)的深處,靠近腸道表面的上皮細胞。Donaldson和他的和作者們猜測這種空間環境是單個細菌種類站位腳跟并建立穩定的據點所必需的。
這些研究人員接下來旨在確定是什么機制允許脆弱擬桿菌在腸道內的如此一種環境中定植。他們發現每個脆弱擬桿菌都被包裹在較厚的由碳水化合物組成的莢膜中。莢膜通常與試圖掩蓋自己而免受身體免疫系統識別和攻擊的病原菌存在關聯。缺乏這種莢膜的突變細菌不能在腸道粘膜層中聚集和棲息。因此,這些研究人員猜測莢膜碳水化合物是脆弱擬桿菌菌株在腸道中獨占它們的空間環境所必需的。
鑒于已知細菌莢膜與免疫系統對病原菌作出的免疫反應存在關聯,Donaldson和Mazmanian推測免疫系統也可能對脆弱擬桿菌莢膜產生免疫反應。事實上,他們發現抗體,即牢牢抓住特定細菌或病毒并對它們進行標記從而使得其他的免疫細胞吞噬和破壞它們的免疫蛋白,結合到腸道中的脆弱擬桿菌莢膜上。一種特殊類型的抗體,即免疫球蛋白A(IgA)---事實上,在人體中,它是zui為大量產生的抗體類型---在整個腸道中發現到,但是它的特異性功能一直是神秘的。
通常,抗體反應意味著致病菌即將死亡。但令人好奇的是,IgA不會對通常在腸道中生存的大多數細菌產生不利影響。就脆弱擬桿菌而言,這些研究人員發現IgA實際上有助這種細菌粘附到腸道上皮細胞上。此外,在缺乏IgA的小鼠中,這種細菌在腸道表面上定植并保持長期穩定方面不太成功。
3.Science:巨噬細胞竟是維持乳腺干細胞的“搖籃”
doi:10.1126/science.aan4153
干細胞能夠分化成幾種不同類型的細胞。乳腺干細胞在青春期促進乳房發育并且在妊娠和哺乳期間是非常活躍的。為了更好地理解乳腺干細胞如何調節乳腺發育以及它們如何發生癌變,來自美國和荷蘭的研究人員研究了巨噬細胞如何通過分子信號傳導機制與乳腺干細胞相互作用。他們發現巨噬細胞在維持乳腺干細胞微環境(niche)中發揮重要的作用。相關研究結果于2018年5月17日在線發表在Science期刊上,論文標題為“Notch ligand Dll1 mediates cross-talk between mammary stem cells and the macrophageal niche”。論文通信作者為美國普林斯頓大學的Yibin Kang教授和Rumela Chakrabarti博士。
這些信號傳導機制涉及一種被稱作Notch的蛋白,它是一種被稱作Dll1的信號分子的受體。 Kang實驗室之前的研究已發現乳腺干細胞能夠產生大量的Dll1。在當前的這項新的研究中,這些研究人員敲除了小鼠中的Dll1基因,發現青春期的乳房發育顯著延遲,以及懷孕和哺乳期間的乳房擴張發生延遲。此外,在乳腺發育和妊娠期間,乳腺干細胞的數量減少了。與此同時,與Dll1敲除小鼠相比,Dlll基因完整的小鼠含有的乳腺具有更大的再生能力和分化成成熟的乳房細胞的能力。
這些缺乏Dll1的小鼠在它們的乳腺中也有較少的巨噬細胞。這些研究人員發現,Dll1與Notch2和Notch3受體的結合對保持在乳腺干細胞微環境中較高的巨噬細胞數量是至關重要的,并且對保持這些乳腺細胞處于干細胞狀態也是非常重要的。
這些研究人員還發現Dll1的存在與另一種涉及Wnt蛋白的信號通路中的基因表達有關。 Dll1的表達導致巨噬細胞表達Wnt3、Wnt10和Wnt16基因,這進一步增強了乳腺干細胞的干細胞行為。當這些研究人員通過遺傳手段或化學方法讓小鼠乳腺中的巨噬細胞失活時,乳腺干細胞的活性下降了。
4.Science:揭示外科手術促進胰腺癌擴散之謎
doi:10.1126/science.aao4908
在一項新的研究中,來自美國冷泉港實驗室(CSHL)的研究人員解開了胰腺癌在通過外科手術已成功切除腫瘤的患者中如何傳播的謎團。在接受外科手術后,患者通常在兩周內因術后應激激素(皮質醇)水平激增而經歷免疫系統耗盡。隨著殺傷性T細胞水平下降,孤立的已通過血液循環擴散到肝臟和可能的其他器官中的休眠癌細胞開始生長或轉移。
圖片來自Fearon Lab, CSHL。
對胰腺癌患者而言,外科手術通常并不是一種治療選擇,這是因為大多數患者是在原發性腫瘤已發生轉移后被確診出來的。這有助于解釋為什么僅8%的被確診斷患上胰腺癌的患者在5年后仍然存活著。但醫生們對應該表現得更好的患者出現不良結果感到困惑:少數在確診時腫瘤似乎局限于胰腺中的患者應當適合接受外科手術治療。在許多這樣的患者中,他們的肝臟在外科手術過程中接受檢查后看起來是沒有癌癥的。然而在兩年內,這些患者中的大多數會發生致命性的轉移性癌癥(通常在肝臟中發生)。
Fearon團隊解釋道,在胰腺癌患者接受外科手術移除原發性腫瘤之前,休眠的癌細胞就已存在于這些患者的肝臟中。它們很可能通過血流到達肝臟中的。
免疫系統通過檢測存在于癌細胞外膜上的稱為MHC1和CK19的蛋白來尋找并破壞這些癌細胞。Fearon團隊發現在胰腺癌患者的肝臟中潛伏的癌細胞不表達這些蛋白,因此殺傷性T細胞無法找到它們。在諸如手術后外科應激(其中肝臟中的T細胞被耗盡)的情況下,這些休眠的癌細胞開始再次表達MHC1和CK19標志物并開始分裂,成為轉移性病灶的種子。
5.Science:重大突破!揭示的抗癌藥物長春花堿的完整合成通路
doi:10.1126/science.aat4100
自從20世紀50年代由一個加拿大研究團隊發現一種有價值的天然產物---長春花堿(vinblastine, 也譯作長春堿)---以來,它就一直作為一種抗癌藥物加以使用。它是一種強效的細胞分裂抑制劑,被用于治療淋巴瘤、睪丸癌、乳腺癌、膀胱癌和肺癌。它是在長春花(Madagascar periwinkle)的葉子中發現的。
在一項新的突破性研究中,英國約翰英納斯中心的Sarah O'Connor教授及其團隊在經過15年的研究之后,終于在長春花中基因組中發現了用于合成化學物長春花堿(vinblastine, 也譯作長春堿)的zui后幾個未知的基因。相關研究結果于2018年5月3日在線發表在Science期刊上,論文標題為“Missing enzymes in the biosynthesis of the anticancer drug vinblastine in Madagascar periwinkle”。
在此之前,長春花合成長春花堿的復雜化學機制尚未*得到理解。因此,獲得這種延長壽命的化學物一直是很費力的---它需要大約500kg干燥的長春花葉子來產生1克長春花堿。但是在這項新的研究中,這些研究人員利用現代基因組測序技術鑒定出這種長春花堿合成通路中的zui后幾個未知的基因。這項研究還鑒定出用于產生長春花堿前體分子---包括長春質堿(catharanthine)和水甘草堿(tabersonine)---的酶。人們很容易地利用合成生物學技術將這些酶偶聯在一起用于合成長春花堿。
6.Science:分而治之!利用磁鐵分離出具有更少副作用的藥物
doi:10.1126/science.aar4265
如今,在一項新的研究中,以色列希伯來大學的Yossi Paltiel教授和以色列魏茲曼科學研究所的Ron Naaman教授及其同事們開發出一種突破性的技術,它能夠被用來產生毒副作用更少的藥物。相關研究結果于2018年5月10日在線發表在Science期刊上,論文標題為“Separation of enantiomers by their enantiospecific interaction with achiral magnetic substrates”。
化合物由分子組成。生物學中zui為重要的分子是手性分子。 “手性”,來源于希臘語中的“手”,用于描述看起來幾乎*一樣的分子,它們含有相同數量的原子,但彼此互為鏡像---也就是說一些分子是“左手性的”,而另外一些分子是“右手性的”。這種不同的“手性”是至關重要的,會產生不同的生物效應。
盡管藥物安全性至關重要,但將手性分子分離為它的右手性組分和左手性組分是一個昂貴的過程,需要針對每種類型的分子開發出量身定制的方法。然而,經過十年的合作研究之后,Paltiel和Naaman發現了一種統一的通用方法,它將能夠讓制藥和化學制品廠商輕松且便宜地將右手性分子和左手性分子分離開來。
他們的方法依賴于磁鐵。手性分子與磁性基質(magnetic substrate)相互作用并根據它們的手性方向進行排列---“左手性”分子與這種磁鐵的一個極更好地相互作用,而“右手性”分子與這種磁鐵的另一個極更好地相互作用。這種技術將允許化學制造商保留“好的”手性分子并拋棄導致有害或不良副作用的“壞的”手性分子。
7.Science:新研究有望戰勝致命性的艱難梭菌胃腸道感染
doi:10.1126/science.aar1999
在一項新的研究中,來自美國加州大學歐文分校和哈佛醫學院的研究人員發現了艱難梭菌毒素B(TcdB)如何識別人G蛋白偶聯受體Frizzled蛋白(FZD),即艱難梭菌用來入侵腸道細胞和導致致命性胃腸道感染的受體。這一發現可能為開發針對艱難梭菌的新型抗毒素鋪平道路,而且也顯示出開發新的抗癌藥物的潛力。相關研究結果發表在2018年5月11日的Science期刊上,論文標題為“Structural basis for recognition of frizzled proteins by Clostridium difficile toxin B”。論文通信作者為加州大學歐文分校的Rongsheng Jin教授和哈佛醫學院的Min Dong博士。
在艱難梭菌感染中,TcdB靶向結腸上皮細胞并與FZD受體結合。這些研究人員發現在這個結合過程中,這種毒素將FZD中的某些脂質分子鎖定,這會阻斷調節結腸干細胞更新和結腸上皮分化的關鍵Wnt信號傳導。
這些研究人員獲得的初步數據表明他們鑒定出的一種無毒的TcdB片段能夠顯著地抑制存在Wnt信號傳導失調的某些癌細胞的生長。針對這方面的申請已被提交。
8.Science:鑒定出人體zui為致命性瘧原蟲的基因組漏洞
doi:10.1126/science.aap7847; doi:10.1126/science.aat5092
為了理解瘧原蟲需要哪些基因,在一項新的研究中,來自美國南佛羅里達大學和英國維爾康姆基金會桑格研究所的研究人員破壞了惡性瘧原蟲的5400個基因中的幾乎每個基因。令人吃驚地,他們發現這些基因中的一半以上是這種瘧原蟲在紅細胞中生長所必需的。相 關研究結果發表在2018年5月4日的Science期刊上,論文標題為“Uncovering the essential genes of the human malaria parasite Plasmodium falciparum by saturation mutagenesis”。
來自維爾康姆基金會桑格研究所的研究人員在去年利用小鼠瘧原蟲---伯氏瘧原蟲(Plasmodium berghei)---開展了一項相關的研究(Cell, doi:10.1016/j.cell.2017.06.030),但是致命性的人體瘧原蟲需要采用一種不同的方法。在這項新的研究中,這些研究人員使 用了一種被稱作piggyBac轉座子插入突變的技術隨機地讓惡性瘧原蟲基因失活,隨后開發出一種新的DNA測序技術來鑒定哪些惡性瘧原蟲基因受到影響。
這些研究人員產生38000多種突變,然后尋找沒有發生變化的基因,這意味著它們是惡性瘧原蟲生長所必需的。他們發現2600多個必需基因,其中大約1000個基因在所有瘧原蟲物種中是保守的,并且具有*未知的功能。此外,他們發現的很多必需基因位于蛋白酶體通路 中,這就使得這個通路成為克服青蒿素耐藥性的一個良好靶標。
9.Science:細胞毒性T細胞竟讓自身免疫疾病更加嚴重!
doi:10.1126/science.aao4555
在一項新的研究中,來自英國帝國理工學院的研究人員利用小鼠模型和人細胞樣品,研究了免疫系統中的一種特定的被稱作C1q的組分。相關研究結果發表在2018年5月4日的Science期刊上,論文標題為“C1q restrains autoimmunity and viral infection by regulating CD8+ T cell metabolism”。
圖片來自Imperial College London。
C1q分子是補體系統的一部分。當身體遭受細菌或病毒等入侵者攻擊時,補體系統協助發出警報,并且協助身體開展免疫防御。一小部分人不能夠產生C1q分子,也因此患上狼瘡。
這些研究人員發現C1q在調節一種保護身體免受病毒和癌癥攻擊的免疫細胞如何消耗它們的能量---一種被稱作代謝的過程---中發揮著重要的作用。特別地,C1q控制著這種被稱作細胞毒性T細胞(即CD8陽性T細胞)的免疫細胞的存活和功能。這些免疫細胞就像是免疫系統的保鏢,摧毀給身體帶來威脅的病毒等入侵者或者發生癌變的細胞。他們發現當這些細胞毒性T細胞的數量變得太高時,它們開始發生功能故障和攻擊身體,而且狼瘡癥狀變得更加嚴重。這可能就是狼瘡患者當遭受病毒感染時突然癥狀發作的原因。
帝國理工學院的Marina Botto教授解釋道,盡管狼瘡的zui初觸發因素仍然是未知的,但是這種疾病可能是由病毒感染觸發的細胞毒性T細胞增殖得以持續存在。
10.Science:為何輕微觸摸就會導致嚴重的瘙癢?
doi:10.1126/science.aar5703; doi:10.1126/science.aat5617
如今,在一項新的研究中,來自美國華盛頓大學圣路易斯醫學院的Hongzhen Hu和同事們通過研究小鼠發現皮膚中的被稱作梅克爾細胞(Merkel cell)的觸覺受體的數量會隨著這些小鼠衰老而下降。他們也發現具有干性皮膚的小鼠具有更少的觸覺受體。當利用科學家們用來研究瘙癢反應的毛發狀尼龍裝置戳這些小鼠時,沒有如此多的梅克爾細胞使得瘙癢更可能成為問題。相關研究結果發表在2018年5月4日的Science期刊上,論文標題為“Piezo2 channel–Merkel cell signaling modulates the conversion of touch to itch”。
Hu說,“隨著梅克爾細胞的數量下降,與觸覺有關的瘙癢問題增加了。梅克爾細胞究竟發揮什么作用仍然并不是清楚的,不過我們的發現提示著它們有助于控制這種瘙癢反應。當你失去這些細胞時,它們抑制瘙癢的能力也就喪失了。”
在進一步的實驗中,這些研究人員研究了經過基因改造的小鼠:它們的梅克爾細胞能夠利用一種化合物加以激活。當讓這些小鼠服用這種化合物時,它們觸摸這種毛發狀尼龍裝置時更不可能發生瘙癢。
這些研究人員還鑒定出第二個潛在的治療靶點---梅克爾細胞表面上的一種似乎控制瘙癢的蛋白。這種稱為Piezo2的蛋白位于梅克爾細胞的細胞膜表面上。在這些小鼠實驗中,他們發現Piezo2蛋白在控制梅克爾細胞抑制瘙癢中發揮著作用。(生物谷 )