
電話:
021-67610176傳真:

經過生物工程改造以表達治療靶向位點的腫瘤細胞已成為未來抗腫瘤治療的希望之星。然而,尚未有研究結果闡明這些改造的腫瘤細胞特異性靶向的細胞表面受體及經其治療后的療效。研究人員設計并合成了能夠對原發性和復發性腫瘤具有特異性配體的治療性腫瘤細胞,并在抗性癌細胞和敏感性癌細胞兩種細胞中開發了兩種治療技術。該研究展示了工程化癌細胞的治療潛力,并對該技術在初發、復發和轉移性腫瘤中進行臨床應用有很強的指導意義。

轉移性腫瘤新克星-自靶向腫瘤細胞
近年來,隨著分子生物學、醫學影像技術、藥物研發及手術技術的不斷發展,許多先前被認為是“不可治愈”的腫瘤類型已經被不斷攻破。然而,許多特發性和系統性的腫瘤類型,尤其是一些轉移性腫瘤,仍然面臨無藥可用、無手段干預的情況。
近幾年,一些研究試圖利用腫瘤細胞的自歸巢(Self-homing)特性將抗腫瘤制劑依靠歸巢的腫瘤細胞自靶向至原發性腫瘤。而目前有希望的方法包括使用腫瘤細胞遞送溶瘤病毒、使用表達zi殺基因的工程化腫瘤細胞將死亡信號轉移到鄰近的腫瘤細胞,以及通過能夠影響血管生成的工程化癌細胞改變腫瘤微環境。
然而應用這種自靶向腫瘤細胞同樣是把shuang刃劍—由于轉基因的自毒性導致這些自靶向腫瘤細胞過早的消耗進而影響治療效果;由于自靶向細胞的長期存活導致繼發性腫瘤的產生。為此,研究人員對這些重新復位的自靶向腫瘤細胞進行了深入的研究并利用CRISPR-Cas9基因編輯技術對其進行改造增強這些細胞的終抗腫瘤特性。
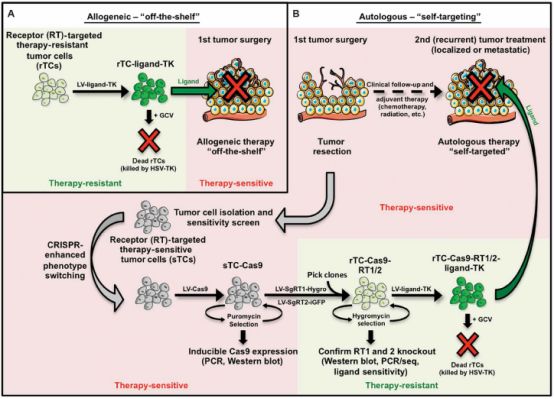
殺傷與被殺傷,反復消滅腫瘤細胞
研究人員首先篩出細胞死亡受體(death receptor,DR)敏感的膠質母細胞瘤(sGBM)和3種抗細胞死亡受體的膠質母細胞瘤(rGBM),通過RT-PCR反轉錄發現所有的sGBM均能夠表達死亡受體,進而在受體與配體結合后啟動細胞凋亡途徑。
另外3種rGBM均不表達該受體,因此它們也不會因DR配體的存在而凋亡。研究人員利用慢病毒使rGBM能夠持續表達DR的配體,并且證明經過基因改造的rGBM在不受DR信號的影響下能夠大量消滅sGBM。
敏感型的膠質母細胞瘤(sGBM)被消滅了,那如何保證導入的抗性母細胞瘤(rGBM)不產生繼發性腫瘤呢?研究人員將更替洛韋(GCV)轉化酶利用基因編輯技術導入rGBM當中,是這些細胞對更替羅韋更加敏感。就此,研究人員便可以利用改造后的rGBM殺滅sGBM,同時利用更替洛韋殺滅rGBM。
CRISPR基因編輯:將膠質母細胞瘤研究成果推向各類腫瘤治療
研究人員首先利用CRISPR基因編輯技術敲出了sGBM中的DR4和DR5基因,制備成了DR-knockout(KO)-GBM,同時也驗證了利用該基因編輯技術可以對其他腫瘤細胞進行相同的處理。
介此,對于同種異型的腫瘤,可利用異體受體非敏感型腫瘤細胞殺滅患者體內受體敏感型腫瘤細胞,再使用更替洛維消滅導入的受體非敏感型腫瘤細胞。對于自體腫瘤,可將患者手術中所獲腫瘤細胞利用CRISPR基因編輯技術敲除受體基因并導入GBV轉化酶基因,經改造后的腫瘤細胞可用于消滅轉移性和復發性腫瘤。
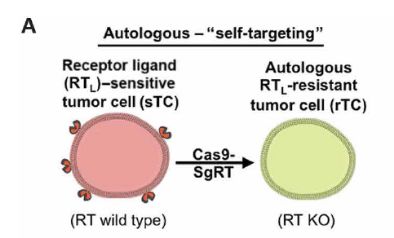
該研究的意義在于揭示了工程化受體靶向腫瘤細胞在治療原發性,復發性和轉移性腫瘤中的可行性和安全性。 同時,也為工程化腫瘤細胞進入臨床實驗打下了堅實的實驗理論基礎。
參考文獻:
Clemens Reinshagen, Deepak Bhere, Sung Hugh Choi, Stefan Hutten,Irina Nesterenko. CRISPR-enhanced engineering of therapy-sensitive cancer cells for self-targeting of primary and metastatic tumors
(轉化醫學網)